2022年2月8日,Science在线发表了中国科学院上海药物研究所徐华强和尹万超团队与合作单位共同研究的题为“Structures of the Omicron Spike trimer with ACE2 and an anti-Omicron antibody”的最新成果。该研究解析了新冠病毒奥密克戎(Omicron)变异株刺突蛋白,以及分别结合其受体ACE2和广谱抗新冠抗体JMB2002的高分辨冷冻电镜结构,阐述了Omicron变异株传播迅速和免疫逃逸的分子机制,并揭示了治疗抗体JMB2002全新的作用机制,为广谱抗新冠抗体的设计和研发提供了新思路。

原文链接:
https://www.science.org/doi/10.1126/science.abn8863
由于新冠病毒遗传载体是RNA,突变频率高,已出现多种 “令人担忧的变异毒株”,不断给全球疫情防控带来新的挑战。特别是最新出现的Omicron变异株,正在全球肆虐,引起了新一轮感染高峰。与近2年发现的多种变异毒株不同,新冠病毒Omicron变异株突变位点数量多,在病毒刺突蛋白突变就多达37处。目前,有关这些突变如何影响Omicron变异株的感染性以及导致免疫逃逸机制都不清楚。而近期的研究显示,目前多种针对新冠病毒的中和抗体对Omicron变异株无效或效力显著降低。因此,深入理解Omicron变异株的传播和感染的分子机制,并开发针对Omicron变异株的特异性治疗抗体迫在眉睫。
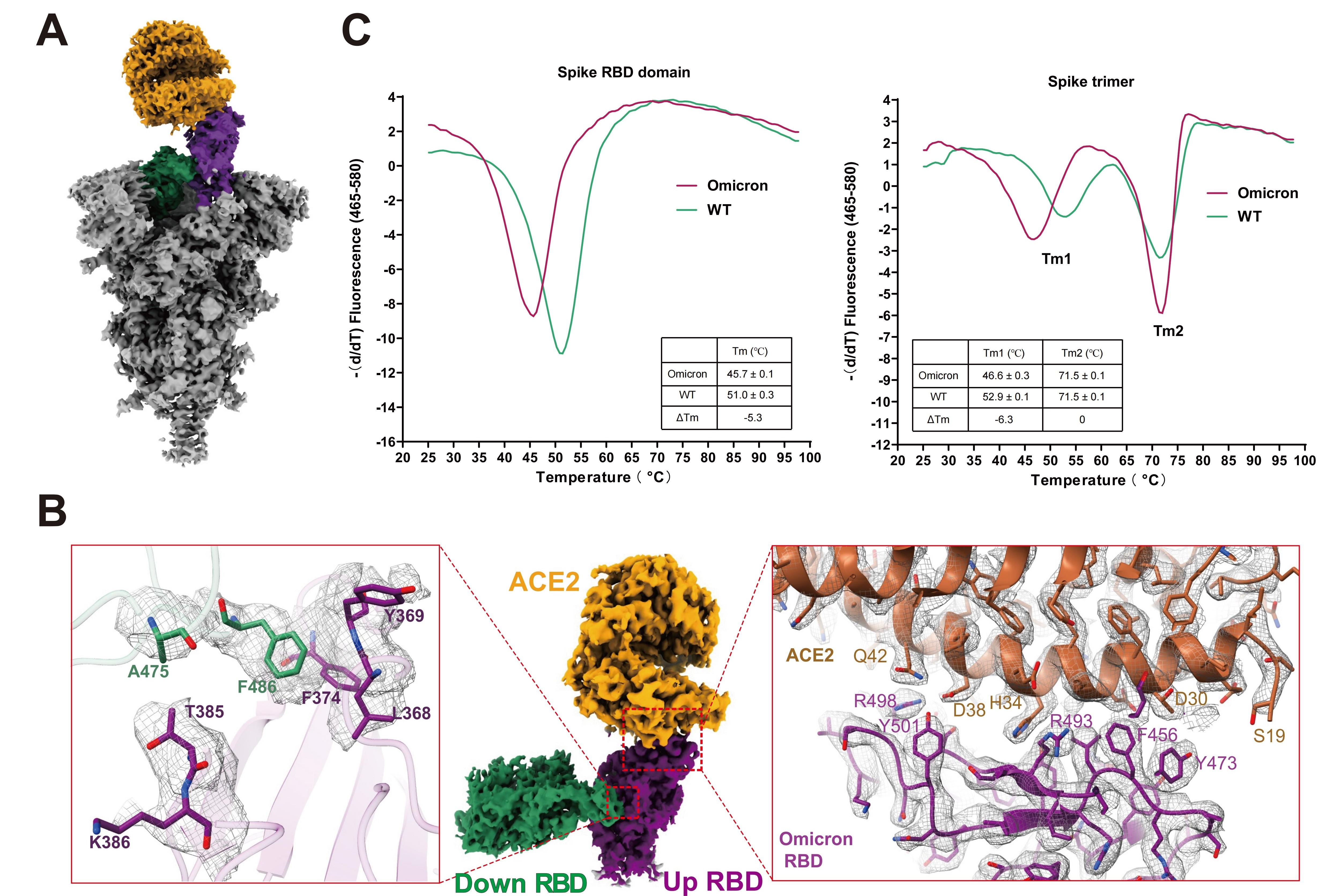
图1 Omicron突变株新冠病毒刺突蛋白结合受体ACE2的结构。A展示Omicron突变株刺突蛋白结合ACE2结构的整体构象,B为RBD-RBD二聚体,以及RBD结合ACE2的相互作用界面,C为刺突蛋白的热稳定分析实验。

动图1 Omicron突变株新冠病毒刺突蛋白结合受体ACE2的结构
面对严峻的疫情防控形势,中科院上海药物研究所徐华强和尹万超团队紧急攻关,迅速解析Omicron变异株刺突蛋白以及结合人源受体ACE2的高分辨率冷冻电镜结构(图1A和1B)。生化水平实验显示,Omicron变异株刺突蛋白结合其受体ACE2相比于野生型有显著的增强,提高近10倍;从解析的结构可以观察到Omicron变异株刺突蛋白三聚体内相邻RBD特异的相互作用,形成的RBD二聚体(图1B),可以稳定Omicron变异株的刺突蛋白特定的RBD处于开放的状态;热动力学实验显示,Omicron变异株的RBD高度灵活,且不稳定,其热溶解温度降低了超过5 °C(图1C),使得刺突蛋白更容易从闭合构象向开放构象转换。Omicron变异株刺突蛋白RBD的相互作用及不稳定性,促进Omicron变异株刺突蛋白与ACE2的相互作用,从原子水平解释了Omicron变异株传染性增强的潜在机制。
同时,该研究团队解析的结构显示Omicron变异株刺突蛋白的大部分突变位点位于蛋白表面,包括多个抗原表位,这从结构上解释了Omicron变异株可以抵抗大部分中和抗体的分子机制。
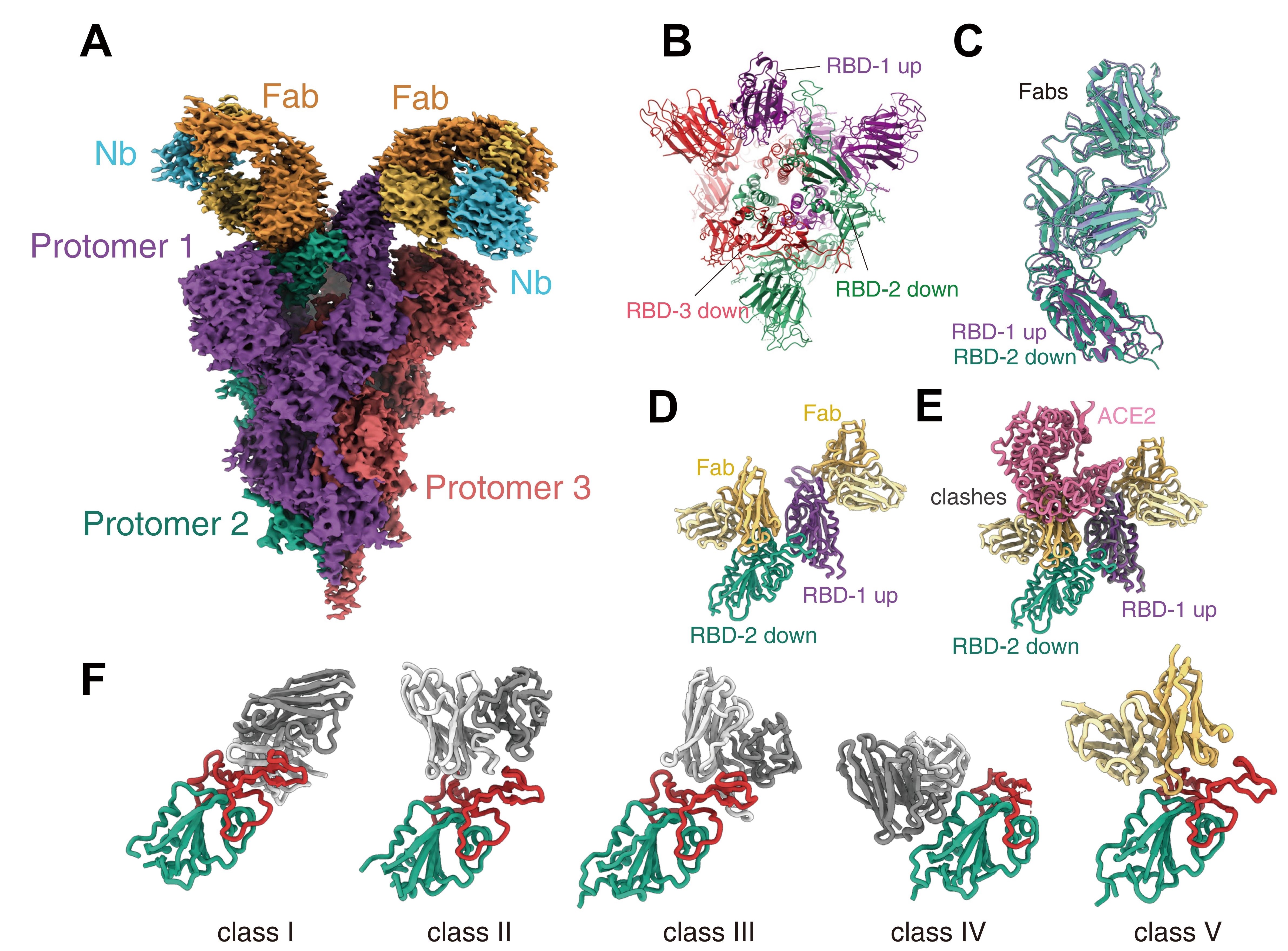
图2 Omicron变异株新冠病毒刺突蛋白结合抗体JMB2002的结构。A展示JMB2002抗体结合Omicron变异株刺突蛋白的整体结构,B为结合JMB2002抗体的结构中Omicron变异株刺突蛋白的构象,C为与JMB2002抗体结合的两个RBD的结构比较,D为JMB2002抗体结合Omicron变异株刺突蛋白的结构中RBD-RBD的二聚体,E展示了结合的JMB2002抗体阻碍受体ACE2的识别,F为抗新冠病毒中和抗体的分类,JMB2002抗体为新型抗体,被归为第五类。

动图2 Omicron变异株新冠病毒刺突蛋白结合抗体JMB2002的结构
在合作单位的支持下中科院上海药物所徐华强和尹万超团队进一步解析了Omicron变异株刺突蛋白与特异性治疗抗体JMB2002的结构(图2A-C)。该抗体已完成了一期临床试验,具有较强的治疗效果和较高的安全性。
生化水平结合实验显示,该抗体对Omicron变异株刺突蛋白的结合力是对野生型的4倍,展示出抑制Omicron变异株的潜力。从解析的复合物结构中,研究团队发现Omicron变异株刺突蛋白三聚体内相邻RBD同样存在特异的相互作用并形成稳定的RBD二聚体(图2D),这显示RBD二聚体是Omicron变异株刺突蛋白一个特有的结构特征,在其功能发挥中起到重要作用;结构比较显示,结合的JMB2002抗体阻碍受体ACE2的识别(图2E),同时,JMB2002抗体片段以一种新的构象结合在RBD的受体结合基序的背部,是一种新型作用机制的抗体(图2F)。
上海药物所尹万超研究员、徐有伟博士、徐沛雨博士和博士后吴灿荣等为该研究的共同第一作者。上海药物所徐华强研究员和尹万超研究员等为该研究的共同通讯作者。
关于公司创始人 徐华强 博士
创始人徐华强博士:长期从事核受体和GPCR的结构研究与药物开发,在结构解析、信号传导机制、新功能发现以及相关药物研发方面取得了一系列创新性成果,解析了人体近1/3核受体和一系列重要GPCR的三维结构,在国际知名学术期刊上发表研究论文260余篇,其中Cell、Nature、Science共30余篇;获得专利10余项,荣获第十三届“谈家桢生命科学成就奖”等多个奖项;此外,徐华强博士还参与和领导过Advair(舒利迭)、AVANDIA(罗格列酮)等重磅药物的研发。
关于凯思凯迪
凯思凯迪成立于2017年,以靶向核受体和GPCR药物的原始创新研发为特色,专注于代谢性疾病和炎症性疾病等未被满足的重大临床需求,聚焦创新药物的早期发现、药物开发和后续商业化。公司围绕经科学和临床验证的核心靶点,建立起完善的、全周期的小分子药物研发核心技术平台体系,主要包括药物设计及合成平台、分子细胞分析平台、药效评价平台、药物代谢分析平台和体内毒理评价平台等。公司突出原创优势,注重差异化创新药物开发,现已建立了丰富且风险平衡的I类新药产品管线。核心品种靶向FXR的非胆酸类完全激动剂CS0159,已于2021年10月、2022年1月分别获得FDA和NMPA批准开展临床研究,目前在美国启动了针对原发性硬化性胆管炎(PSC)适应症的临床I期试验。




